
循证医学与连串研究中心
Cochrane中国协作网成员单位
Affiliate of the Cochrane China Network

近日,中国学者受邀在《英国临床药理学杂志》(British Journal of Clinical Pharmacology)以“Pharmacovigilance in China: Evolution and future challenges”为题介绍中国药物警戒的发展成就及面临的挑战。

2019年新修订的《中华人民共和国药品管理法》确立了药物警戒制度在中国的法律地位,该法第十二条规定“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制。”这距离2012年欧盟药物警戒立法仅7年,距离2002年世界卫生组织(WHO)出版“The importance of pharmacovigilance”一书也只有17年。考虑到1988年中国刚启动药品不良反应监测工作试点,直到1999年才正式实施药品不良反应报告制度,中国药物警戒的发展相当迅速。
药品警戒强调药品全生命周期的风险管理。药品的风险涉及上市前研究、产品注册到上市后的生产、流通、临床使用及监管等各个阶段,既可能是药品固有的风险,也可能与人为因素有关,如产品质量缺陷、处方错误、不合理使用等,所有这些都有可能对患者健康有潜在影响。建立药物警戒制度的目的就是通过实施药品全生命周期的风险管理,从而达到风险最小化的目标。药品不良反应自发报告数据在发现药品风险信号方面有一定价值,但也存在明显的局限性,比如漏报比较常见,报告质量相对较差,缺乏用药人数信息、无法准确量化风险等。考虑到药品不良反应监测制度的不足,许多国家都实施了药物警戒制度以提升其风险管理能力。
2021年国家药监局颁布了《药物警戒质量管理规范》,这是中国药物警戒发展史上的里程碑。然而,距离达到良好药物警戒实践的理想目标,中国还面临许多问题与挑战。首先,自发报告系统仍是中国药物警戒活动的主要数据来源,还需要获取更多数据用以支持科学监管决策;中国践行以人民健康为中心的药品监管理念,加快了临床急需药品及罕见病药物的审评审批速度,这些药品的上市后安全监管需要加强;作为药品安全第一责任人,药品上市许可持有人(MAH)的药物警戒能力还需要提升;中国的医学教育普遍缺乏药物警戒专业课程教育等。药品监管部门已经认识到这些问题,通过实施中国药品监管科学行动计划,培训提升药物警戒人员的专业能力,探索主动监测模式,强化与利益相关方的合作等措施,以有效推动中国药物警戒制度发展。
作者也介绍了中国在药物警戒领域取得的一些主要成就。在临床试验期间的药物警戒方面,国家药监局药品审评中心(CDE)结合我国实际情况,在遵循E2A、E2B、E2F等ICH指南的前提下,制定和发布了一系列技术标准和规范性文件,构建了药物临床试验期间SUSAR个例报告电子传输系统,用以规范药物临床试验期间可疑且非预期严重不良反应(SUSAR)及研发期间安全性更新报告(DSUR)的接收、分析和评估。从2018年5月1日起,CDE开始接收申办者(Sponsor)提交的SUSAR个例报告。2019年4月26日,药品审评中心在官网开通DSUR递交通道,开始接收Sponsor递交的DSUR报告。在2020年,Sponsor总计向CDE提供了1775份DSUR报告。CDE基于SUSAR个例报告、DSUR的分析、评估结果,以及对Sponsor提交风险管理信息的评估结果,认为该临床试验存在安全风险的,将根据风险情况向Sponsor发出《临床试验风险控制通知书》、《暂停临床试验通知书》、《终止临床试验通知书》等,并实施相应的风险监管,以更好地保护受试者的安全。2020年CDE共对18个药物临床试验发出了相关通知书,这在中国临床试验期间的安全管理方面具有标志性意义。
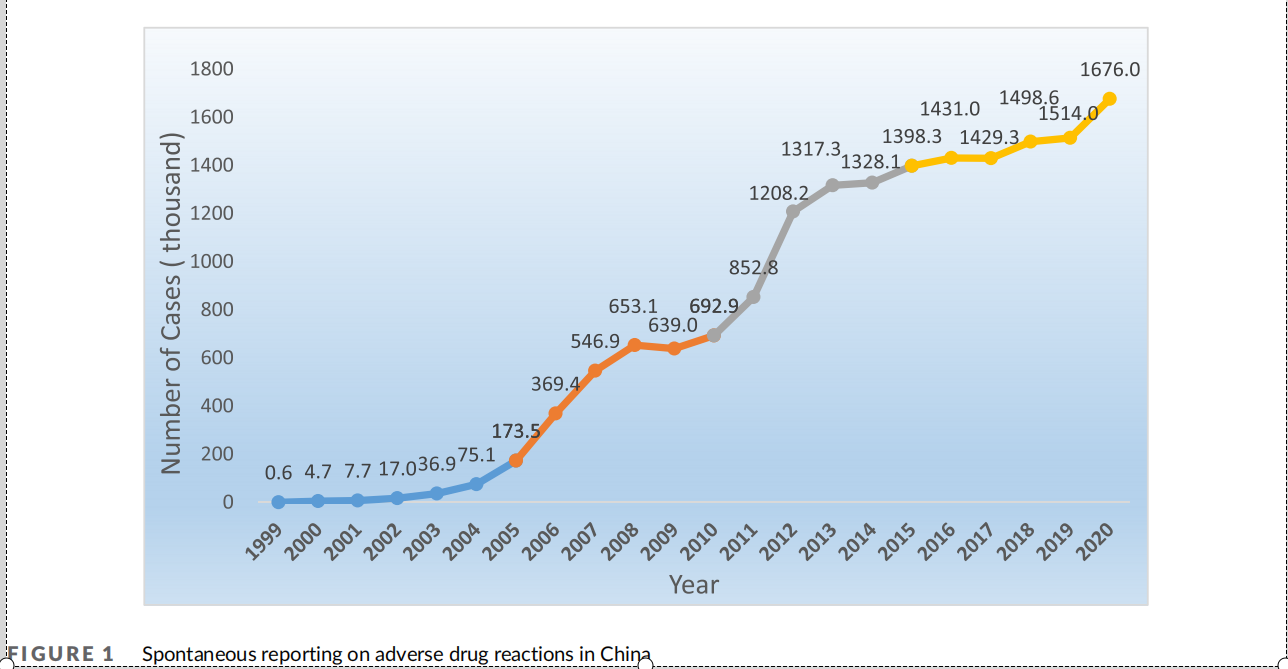
在药品上市后的药物警戒方面。不良反应监测机构的职能也逐步向药物警戒转变。2019年5月,中国深圳市成立了中国首家药物警戒机构,内蒙古、山西、河北、临沂等省/自治区及城市也先后组建了药物警戒中心。近20年来,国家药品不良反应监测系统(CADRMS)的性能及功能已经得到很大提升。在本世纪初,中国的医生还需要填写纸质的药品不良反应报告表;2003年后,国家药监局药品评价中心(CDR)发布了单机版的药品不良反应监测报告软件,药品不良反应可以电子邮件的形式报告;2010-2012年,CDR建设完成了基于互联网的CADRMS,并先后开发了数据分析、信号检测、预警管理、定期安全性更新报告管理等功能模块,ADR报告的数量也随之快速增长。2020年,中国每百万人口平均报告数达到1,251份,已经接近或达到许多发达国家的水平。1999年至2020年期间CADRMS收到的ADR报告数量累计已达到1,687万份。
在中药药物警戒方面,综合多种来源数据分析显示,中药总体上是安全的。2020年,根据中国商务部发布药品流通行业运行统计分析报告,中药约占中国药品市场份额的16.4%,化学药约占71.5%,医疗器材及其他占12.1%。同期,根据国家药监局发布的国家药品不良反应监测年度报告,怀疑药品为中药的不良反应报告数量占全部自发报告的13.4%,化学药占83.0%,生物制品及无法分类者占3.6%;怀疑药品为中药的严重不良反应报告数量占全部严重不良反应报告的6.3%,化学药占90.3%,生物制品及无法分类者占3.4%。上述数据提示,多数中药的不良反应报告中严重不良反应报告所占的比例可能相当低,但仍有一些中药可能存在相当数量的严重不良反应报告,如何根据中药特点发现并评估中药的风险信号非常重要。 近年来,中国的学者也与国际的同行在传统药物安全领域开展了广泛的合作交流,来自中国的学者参与了CIMOS的《药物性肝损伤国际共识》(2020年),并在该书Liver Injury Attributed to Herbal and Dietary Supplements一章中分享了他们关于Causality assessment strategies and methods for Chinese medicines-induced liver injury的最新研究成果。传统药物及植物药的安全性是药品安全领域中值得全球关注的一项内容,因而这些合作对双方都是非常有利的。
该论文已在线发表于国际临床药理学领域权威杂志《英国临床药理学杂志》(British Journal of Clinical Pharmacology),国家药监局药品评价中心宋海波主任药师、北京大学公卫学院孙凤副教授、解放军总医院第五医学中心肖小河研究员为共同通讯作者,宋海波主任药师为第一作者,国家药监局药品审评中心裴小静主任药师、国家药监局药品评价中心沈传勇主任等为共同作者。